ATOM.
SADRŽAJ: 1. Daltonova nauka, 722; 2. Avogadrov zakon, 722; 3. Kinetička teorija plinova, 723; 4. Periodički sustav elemenata, 723; 5. Jedinstvo tvari, 723; 6. Broj atoma, 723; 7. Atomi u lecima, 723; 8. Elektrizirani atom, 724; 9. Pojedinačni atom, 724; 10. Pretvorba atoma; izotopi, 724; 11. Zgrada atomova, 725; 12. Atomska ljuska, 725; 13. Atomska jezgra, 726; 14. Veličina atoma, 726; 15. Atom točka, 727; Literatura, 727.
1. Daltonova nauka. U fizici i kemiji »atom« označuje najmanje istovrsne čestice, od kojih se sastoji elemenat, t. j. tvar, koja se kemijskim postupkom ne da rastvoriti u jednostavnije. Atomskih vrsti ima dakle toliko, koliko i elemenata, te postoje atomi zlata, kisika, sumpora i t. d. Prve brojevne spoznaje o atomima zahvaljujemo kemiji. Dalton je naučavao, da su atomi jednoga elementa jedni drugima jednaki, poimence jednako teški. Kemijski spoj se sastoji iz jednakih molekula, sastavljenih iz atoma onih elemenata, koji izgrađuju spoj. Umjesto oblika i veličine atoma važnih u starijim spekulacijama ističe se sada pojam atomne težine. Vođen tim pomislima stvorio je Dalton teoretsku podlogu osnovnom zakonu kemijskog spajanja: zakonu stalnih uteznih omjera. U drugu ruku mogao je zaključiti 1808 i nešto novo: da vrijedi zakon višestrukih uteznih omjera, što je kemijska analiza doista sjajno potvrdila (→ stehiometrija). S tim bijaše povezana smiona misao Daltonova, da se atomne težine mogu ispoređivati. Razmotrimo primjer vode. Za nju se našlo, da je sastavljena iz kisika i vodika i to tako, da na 1 g vodika dolazi 7∙9383 g kisika. Ako sada znamo, da molekula vode sadržaje 2 atoma vodika i 1 kisika, zaključujemo, da 1 atom kisika važe 7∙9383 puta više nego li 2 atoma vodika, dakle 15∙8766 puta više negoli 1 atom vodika. Kolika je težina tih atoma izražena gramima, pri tome ne treba znati. — Kao primjerena jedinica za atomne težine danas služi 1/16 težine atoma kisikova, tako da je atomna težina kisika 16 ∙0000, vodika 1∙0078. Molekularna težina vode jednaka je 18∙0156, jer atom kisika važe 16∙0000, a 2 atoma vodika 2∙0156.
Dalton nije bio siguran pri određivanju molekularnog sastava, te je na pr. za molekulu vode uzeo, jer je najjednostavnije, da je građena iz 1 atoma vodika i 1 atoma kisika. Kad bi to bilo, bio bi atom kisikov samo 7∙9383 puta teži od atoma vodikova. I tako su Daltonu omjeri atomnih i molekularnih težina velikim dijelom pogrješni. Prva je tablica iz 1803. Dalton je atome označivao različitim kružnim znacima, atom vodikov: O, kisikov ʘ, molekulu vode Oʘ. Današnje oznake — prema Daltonu »strašne«, jer da »zasjenjuju ljepotu atomističke teorije« — uveo je Berzelius 1811: prvo (veliko!) ili prva dva slova latinskog ili latiniziranog imena elementa. Tako znači H atom vodikov (ne vodik), O atom kisikov, H2O molekulu vode.
Broj, koji kazuje atomnu težinu, znači i masu njegovu. Volimo govoriti o atomskoj masi, kad se spomenuti broj određuje bez vaganja, kao t. zv. troma masa.
2. Avogadrov zakon. Nesigurnost pri određivanju sastava najznatnijih molekula uklonjena je Avogadrovom hipotezom. Da objasni, zašto se plinovi kemijski spajaju u jednostavnim prostornim omjerima, Avogadro tvrdi (1811), da plinovi u jednakim obujmovima imadu jednak broj molekula (uz jednak tlak i jednaku temperaturu); molekule plinova-elemenata nisu isto što i atomi, već da su sastavljene, te je na pr. vodikova molekula građena iz dva atoma. Danas znamo mnoge primjere, gdje je molekula plina isto što i atom. Te pomisli nisu samo omogućile, da se dokučio sastav molekula, koje nastaju spajanjem plinova, već i to. da se isporede molekularne težine plinova bez obzira na njihovo kemijsko spajanje: ako je 1 litra kisika 16 puta teža od 1 litre vodika, a prema Avogadrovoj hipotezi ti obujmovi sadržavaju jednako mnogo molekula, onda svaka molekula kisika važe 16 puta više negoli molekula vodika; a ako te molekule sastoje svaka od dva atoma, onda je i atom kisikov 16 puta teži od atoma vodikova. Te hipoteze za dugo nisu bile priznate. Nije ni čudo, ako se sjetimo, da su i o Daltonovoj nauci mnogi sumnjali, premda je njegova nauka dovela do važnog zakona višestrukih omjera. Avogadrova se hipoteza nije mogla podičiti takvim uspjehom, već je bila ishitrena samo, da tumači već poznate činjenice. Osim toga Daltonove pomisli bile su jasne i vjerojatne, dok za Avogadrove nije postojao nikakav teoretski osnov. Ne osvrćući se na Avogadrovu nauku mnogi su kemičari i nadalje u opreci s njom bilježili molekulu vode HO. Do pobjede pomogao je toj nauci tekar Cannizzaro 1858.
Današnje značenje imena »atom« i »molekula« ustalilo se postepeno. Dalton zove i molekule i atome atomima, Avogadro jedne i druge molekulama.
3. Kinetička teorija plinova. Nezavisno o kemiji dovodi na Avogadrov zakon i fizika (Maxwell 1859). Kinetička teorija plinova tvrdi, da u plinovima molekule lete na sve strane i udarcima proizvode tlak. Ako je m masa molekule, b2 srednja vrijednost kvadratâ molekulskih brzina, n broj molekula u jedinici obujma, onda je, uz zgodne jedinice, tlak p=m<znak>XnXb2/3. No prema zakonu jednake razdiobe energije treba da je srednja kinetička energija m<znak>Xb2/2 za molekule različitih plinova jednaka (kod iste temperature). Da sada prema formuli izađe za dva plina isto p, treba da je za ta dva plina n, broj molekula jednak.
4. Periodički sustav elemenata. Dok se pojam atomske težine postepeno razvio do najznatnijeg osnova kemijske sistematike i simbolike, Mendelejev je 1869 našao u njemu još i više: atomska težina odlučuje, kakva su svojstva elementa. Redajući atome po težinama dobio je niz, u kojemu se kemijska svojstva od člana do člana mijenjaju nekom pravilnošću, periodički. Niz se poradi toga mogao svrstati u tablicu, koja se — prema tadanjem znanju elemenata i at. težina — započela ovako:
H 1; Li 7; Be 94; B 11; C 12; N 14; O 16; F 19; Na 23; Mg 24; Al 274; Si 28; P 31; S 32; Cl 355; K 39; i t. d.
Periodičnost se razabire u tom, što Na, koji slijedi iza F, ima svojstva slična kao Li, isto tako K; Mg kao Be; Al kao B i t. d. Zakon toga niza nije jednostavan, jer evo H dobiva zasebno mjesto. Još više se to vidi, kad se tablica nastavi. Međutim da elementi dobiju kemijski valjano mjesto u tablici, morao je Mendelejev nekima, kojima atomne težine nisu bile pouzdane, te težine preinačiti. Tako je uranu U tadanju vrijednost atomne težine podvostručio, te je time U dobio odlično mjesto najtežega atoma. Veća je neprilika bila, što je trebalo ostaviti neka mjesta tablice nepopunjena, kao da bi tamo pristajali atomi elemenata, koji još nisu otkriveni. Na osnovu svojstava atoma susjednih tima prazninama Mendelejev je opisao te hipotetične elemente, i zakratko su se doista našli galij, skandij i germanij s onakvim svojstvima, kako ih je Mendelejev prorekao. Što je dakle isprva bilo slaboća teoretske tvorevine Mendelejeva, prometnulo se u njezin velik uspjeh.
Još je morao, da dobije kemijski valjan poređaj, staviti elemenat telur pred jod, premda bi po atomnoj težini slijedio iza njega. No on bijaše toliko uvjeren o ispravnosti svoje nauke, te je odlučno tvrdio, da ne može biti, da bi atomna težina joda bila dobro određena. Međutim ni današnja tablica atomnih težina u tom ne daje pravo Mendelejevu, te je očito, da se tu radi o anomaliji njegova sustava. Slično vrijedi još i za ove parove susjednih elemenata: kobalt i nikalj, argon i kalij, torij i protaktinij. Ta 4 primjera — a bio bi jedan dovoljan — nesumnjivo pokazuju, da atomna težina ipak nije pravi osnov za građenje periodičkog sustava. Treba da postoji neka druga oznaka atoma, koja bolje i poput kakvog automata izbacuje elemente točno i bez iznimke u poređaju s periodičkom pravilnošću. (Isp. 11.) Golema vrijednost sustava ipak ostaje izvan sumnje.
5. Jedinstvo tvari. Daltonova nauka, da treba oštro razlikovati atome dvaju elemenata, nije nikada mogla sasvim ugušiti uvjerenja o jedinstvu tvari. Da bi atomi različitih tvari mogli biti nešto po svojoj biti i podrijetlu sasvim različno, postalo je sve više nevjerojatno, kako su se množili novo otkriveni elementi. L. Meyer, koji je nezavisno o Mendelejevu — ako i u čednijem radu — gradio periodički sustav, izjavljuje, da ga je u tom poslu vodila misao, »da atomi nisu zadnje, već samo bližnje sastojine molekula«. A i sam Mendelejev kaže, da »atomne težine određuju značaj elementa, kako veličina molekule određuje svojstva sastavljenog tijela«. Doista se zakonitost periodičkog sustava može samo tako razumjeti, da je ona posljedak međusobne povezanosti elemenata i odraz jedinstva tvari. — Značajno je, da se u razvoju znanosti periodički sustav pojavljuje u doba, kad je naoko konačno zabačena nauka o jedinstvu elemenata, koju je iznio Prout. Oslanjajući se na tadanje krupne vrijednosti atomnih težina Prout je ustvrdio (1815), da su atomi građeni od vodikova atoma, najlakšega, i da su atomne težine cijeli brojevi, ako vodikovu uzmemo za jedinicu. Vodik je po Proutu Aristotelova πρώτη ὕλη, od koje je sve sazdano. No veliki Berzelius mogao je na osnovu svojih analiza pokazati, da nema te jednostavne sveze među atomnim težinama, a kasnije Stas, isprva sklon Proutovoj hipotezi, na osnovu novih istraživanja kazuje za nju 1860, da »nije drugo, nego iluzija, puka hipoteza, kojoj iskustvo jasno protuslovi«. Doista su atomne težine prvih 17 elemenata
1∙008 4∙00 6∙94 9∙02 10∙82 12∙00 14∙01 16∙00 19∙00 20∙18 23∙00 24∙32 26∙97 28∙06 31∙02 32∙06 35∙45
te je jasno, da tvrdnja o cjelobrojnim mnogokratnicima ne stoji. Ipak je čudno kako su ti brojevi — uz neke iznimke — cijelim brojevima blizu. De Marignac zato primjećuje, da bi se Proutova osnovna misao ipak dala održati: zar ne bi moglo biti, da uzrok, koji iz atoma vodikovih ili možda sitnijih gradi sastavljene atome, utječe na zakon teže na taj način, da težina sastavljenoga atoma nipošto ne mora biti točno jednaka zbroju težina svojih sastojina? Smiona ta misao za onda — 1860 — ničim drugim nije bila poduprta, te nije mogla spriječiti pada Proutove hipoteze. (Isp. 10.)
6. Broj atoma. Uza sav napredak, što ga je kemija imala zahvaliti atomistici, nisu sve do pod kraj prošloga vijeka umukle sumnje o realnosti atoma, a i o tom, da znanost bez atomističke »hipoteze« ne bi mogla postojati. Pa i oni, koji pristajahu uz nju, većinom su držali, da je broj atoma tako velik, težina njihova toliko sićušna, te nema nade, da bismo ih ikada mogli dokučiti. Drugi opet nejasno zamišljahu težinu atoma beskrajno malenom, broj atoma nekoga tijela beskrajno velikim. Sve su te sumnje prestale, kad je poglavito početkom našega vijeka uspjelo, da se na mnogo vrlo različnih načina odredi težina atoma izražena gramima i u svezi s time golemi broj atoma, što je sadržan u kojojgod danoj množini tvari. Problem je jedan i jednim jedinim brojem rješava se sve. Atom vodikov na pr. važe
0 000000 000000 000000 000001 671 g ili kraće: 1∙671<znak>X10-24 g t. j. 1∙671 kvadriljuntina grama.
Ako to znamo, izlazi težina svih drugih atoma iz kemijske tablice atomnih težina, te je na pr. težina atoma kisikova 16∙0000 : 1∙0078 puta veća od gornjega broja. Isto tako znamo onda težinu svim molekulama, kojih su formule poznate. Nadalje lako onda sračunamo, koliko atoma vodikovih, kisikovih i t. d., koliko molekula vode H2O, koliko molekula sumporne kiseline H2SO4 i t. d. dolazi na 1 gram tvari. Za opće izricanje tih brojeva zgodno je, da se uvede jedinica težine (mase) 1 »gram-atom«. To je onoliko grama nekoga elementa, koliko iznosi njegova kemijska atomna težina, te je na pr.
1 gramatom kisika = 16·000 g
1 gramatom vodika — 1∙0078 g. Ta je jedinica doduše za svaki elemenat druga, ali ona sadržaje kod svakoga elementa jednako mnogo atoma. Broj atoma u 1 gramatomu obično se zove »Avogadrov broj« (predložio Perrin 1909). On je jednak
A = 603100 000000 000000 000000 = 6∙031 X 1023, t. j. 603100 trilijuna.
Iza prvih krupnih rezultata taj se broj sve bolje upoznao, te ga evo danas znamo malne na 4 mjesta. Ovdje iznesena vrijednost (Millikan 1938) smatra se točnom na l‰, te je možemo uz naznaku najveće moguće pogreške bilježiti A = (6 031 ± 0∙006) X 1023.
Nadalje ima u 1 cm3 kojegagod plina (kod 0º C i normalnog tlaka) 26,9 trilijuna molekula. Taj se broj obično zove »Loschmidtov« (predložio Boltzmann 1895). Loschmidt je naime zadužio znanost, kad je vođen teorijom plinova računao veličinu molekula, što je doduše prilično neodređen pojam (1865). Iz njegovih se rezultata dade krupno odrediti broj atoma, te je Loschmidtov rad bio prvi korak k upoznavanju tih veličina.
7. Atomi u lecima. Kristalografija uči, da su atomi u lecu pravilno poredani u ravne nizove. Vođen tom pomišlju Laue je 1912 upotrijebio lece za dobivanje rentgenskih spektara. Iz Avogadrova broja računao je razmak atoma u kristalu, a iz toga na osnovu spektralnog pojava odredio je dužinu vala λ rentgenskih zraka. Kasnije se našlo, da se rentgenski spektri mogu dobiti i optičkom mrežicom i da se λ može naći i bez znanja Avogadrova broja. Ako sada znajući otuda λ načinimo takav spektar još i s pomoću leca, možemo obrnuto odrediti razmak atoma u lecu, a iz toga izračunati broj atoma. — Primijetimo, da je na pr. u slankamenu NaCl središte kojegagod atoma natrijeva udaljeno od središta susjednih atoma klorovih za 0 ∙ 000000 28 mm = 2 ∙ å.
8. Elektrizirani atom. Među metodama određivanja broja A osobito je znatna ona, koja se osniva na elektrolizi, rastvaranju spojeva s pomoću električne struje. Tu se na dvije »elektrode« pušta kroz spoj električna struja, te s njome pozitivni dio spoja putuje na »katodu«, negativni na »anodu«, noseći svaki svoj elektricitet nerazdruživo sa sobom. Na pr. kod elektrolize srebrova nitrata sa 1 gram-atomom srebra (107∙88 g) prelazi na katodu množina elektriciteta 2∙8297 <znak>X 1014 elektrostatskih cgs-jedinica, kako to nalazimo mjerenjem električne struje, vremena njezina toka i vaganjem katode. Ako se uzme, da je i elektricitet »korpuskularnog« sastava i da su mu sve čestice jednako električne, s elektritetom »e«, onda u 1 gramatomu imade tih čestica 2∙8297 <znak>X 1014 : e. Ako najposlije pretpostavimo još i to, da svaki atom srebra nosi 1 naboj e, slijedi, da je A = 2∙28297 <znak>X 1014 : e. Na osnovu takve veze zaključio je već 1874 Stoney kao prvi, koliko je e. Obratno, kad je Millikan glasovitom »metodom kapljice« našao točniju vrijednost e, poslužilo mu je to, da popravi i vrijednost Avogadrova broja (1913).
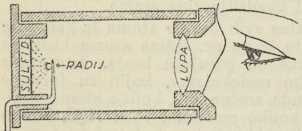 Crookesov spintariskop
Crookesov spintariskop9. Pojedinačni atom. Gorljivi atomist Fechner izrekao je 1854 nadu, da će se možda atomi jedamput »vidjeti i osjećati kao ono što jesu, t. j. u svojoj diskreciji«. To se smiono očekivanje ispunilo, kad je Crookes 1903 našao, da se u tami mogu lupom vidjeti »scintilacije« (scintilla lat. iskra) cinkova sulfida, ako je blizu elemenat radij. U »spintariskopu« (σπινϑηρ, grč. iskra) nalazi se nekoliko mm pred cinkovim sulfidom sićušna množina radija, još dalje sprijeda lupa (v. sl. 1). Oko, kad se prilagodi na tamu, vidi u tom aparatu prekrasan pojav svjetlucanja: iskrice bljesnu na sulfidu sad tu, sad tamo, svaka poradi udarca jedne alfa-čestice, t. j. pozitivno električnog atoma helijeva, izbačenog iz radija. Ovdje dakle, ako baš i ne »vidimo«, ipak »osjećamo« pojedinačni atom, a da je to moguće, treba zahvaliti golemoj brzini čestice, koja iznosi 15.000 km/sek. Fechnerova se slutnja ispunila još i više, nego što je mislio, jer dok je on držao, da će za taj uspjeh trebati usavršiti čovječja osjetila, nije eto trebalo na to čekati. — Za druge načine pojedinačnog zapažanja atoma → Geigerov brojač i Wilsonovu komoricu. — Atomi helijevi mogu se dakle brojiti, pa i to služi za određivanje Avogadrova broja.
10. Pretvorba atoma; izotopi. Od doba Daltonova do kraja prošloga vijeka kemija je unatoč ideji o jedinstvu tvari zamišljala atom kao nešto, što je — praktički uzeto — savršeno nepromjenljivo. Ta protimba spram alkemističke pretvorbe ili transmutacije elemenata jednih u druge bila je u ono doba zacijelo baš i preduvjet velikom napretku. Međutim je nauka o radioaktivnosti oborila to shvaćanje. Rutherford i Soddy pokazaše 1903, da radioaktivnost nije drugo već pretvorba atoma. Za nju je značajno, da je raspadanje, a ne građenje atoma, i da se zbiva spontano, sama od sebe, prema jednostavnom statističkom zakonu. Kod jedne je tvari raspadanje brže, kod druge sporije, pa se radioaktivni elementi razlikuju jedni od drugih u prvom redu baš po svom »polovičnom vremenu T«, vremenu, u kojemu broj atoma spadne na polovicu.
Bilo je jasno, da otkriće transmutacije mora dovesti do novih bitnih spoznaja o atomu. U prvi je mah izbila poteškoća, kako da se svrstaju u periodički sustav novi radioaktivni atomi, njih preko 30, koji su otkriveni u nepuna dva desetljeća. Radilo se o teškim atomima, kojima je trebalo naći mjesta na završetku sustava, gdje je međutim čekalo samo 7 praznih mjesta. Stvar se naskoro objasnila. Kad je otkriven radioaktivni elemenat jonij (T = 83000 god.), pokazalo se, da se on ne može nikojim kemijskim postupkom odijeliti od torija (T = 18 miljarda god.). Slično se našlo, da se ne mogu kemijski razlikovati jedni od drugih elementi radij, mezotorij 1, torij X i aktinij X. I tako redom: svi su se novi elementi dali svrstati u nekoliko hrpa, kojih je svaka sadržavala elemente doduše različne pogledom na radioaktivnost, ali u kemijskom obziru toliko slične, da ih treba smatrati kemijski jednakima. Soddy je to prvi jasno izrekao (1911) i predložio, da se svi elementi jedne takve hrpe stave na isto mjesto sustava, bez obzira na atomnu težinu i na načelo Mendelejeva. Elementi jedne hrpe zovu se prema tome izotopni (pridjev) dotično izotopi (imenica) (ἴσος, jednak, τόπος, mjesto), te su izotopni na pr. jonij i torij, mezotorij 1 i radij, radon i toron i t. d. Na osnovu te pomisli, da kemijski atomi mogu imati takvih podvrsti, mogli su se svi novi elementi smjestiti u periodički sustav bilo zajedno s talijem, olovom, bizmutom, torijem, uranom, bilo na 5 praznih mjesta, tako da čak 2 mjesta sustava ostadoše i nadalje nepopunjena.
Nema međutim izotopa samo među radioaktivnim elementima, već i među stabilnima. Ispitujući kanalne zrake plemenitoga plina neona pokazao je J. J. Thomson (1912), da taj elemenat sastoji od dvije vrsti atoma: jednih, u većem obilju, s atomnom masom 20, drugih s masom 22. U skladu s time mogao je Aston difuzijom rastaviti neon u dva plina ponešto različne gustoće. Osim toga je isti fizičar svojim »masenim spektrografom« (1919 i dalje) ispitao Thomsonov primjer i veliko mnoštvo drugih, te je našao, da je izotopnost i kod stabilnih elemenata vrlo općen pojav. Začudo su izotopi nekoga elementa u prirodi smiješani malne svagdje u jednakim omjerima, tako da je srednja vrijednost atomnih težina njihovih jednaka, gdjegod taj elemenat potražili. Ta je srednja vrijednost upravo atomna težina u kemijskoj tablici. Ona ostaje i nadalje praktički važna, jer se kod kemijske pretvorbe redovno ne mijenja.
Dok se radioaktivni izotopi mogu razlikovati u prvom redu prema brzinama raspadanja, u masenom se spektrografu izotopni atomi odjeljuju jedni od drugih prema svojim masama, pa se tim aparatom baš i mjere mase atomske. Mjerenja pokazaše Astonu, da su mase izotopa vazda blizu cijelom broju. Tako je na pr. atomna masa klorova običnijega (76%) izotopa 34∙98, dok za rjeđi klorov izotop (24%) izlazi 36∙98, prema tome kemijska ili srednja atomna masa (34∙98<znak>X76+36∙98<znak>X24) : (76 + 24)=35∙46. Zakon cjelobrojnosti, pa makar samo približne, nanovo je upućivao na napuštenu Proutovu hipotezu, a postojanje atomskih podvrsti objasnilo je, zašto se ta hipoteza nije mogla potvrditi kemijskim atomnim težinama, koje kao srednje vrijednosti cijelih brojeva ne treba da budu i same cjelobrojne. Što se pak tiče približnosti, moglo je novo doba bez prisilnosti prihvatiti de Marignacovo tumačenje, koje je našlo precizan osnov u priznatom Einsteinovu zakonu ekvivalencije mase i energije.
Cijeli broj, kojemu je masa nekoga izotopa približno jednaka, zove se maseni broj. Tako neonovi izotopi imaju masene brojeve 20 i 22, klorovi 35 i 37, živini — poredani prema obilju — 202, 200, 199, 201, 198, 204, 196. Kao u tim primjerima tako i u drugima maseni se brojevi jednog te istog elementa nikada ne razlikuju za mnogo jedinica. U postocima te su razlike dakle malene, izuzevši najlakše elemente. Atomi stabilnih izotopa obično se bilježe tako, da se kraj atomskih slova stavi gore lijevo ili desno maseni broj, na pr. Ne20 ili 20Ne, Ne22, Cl35, prema tomu formula za t. zv. tešku vodu H22O.
I elemenat kisik, koji je uzet za osnov definicije jedinice atomne težine, smjesa je izotopa. U prirodnoj smjesi najviše imade atoma s masenim brojem 16, njih 99,76%, preostali atomi malne svi imadu maseni broj 18, neznatni ostatak maseni broj 17. No »kemijska« jedinica atomne težine jest 1/16 srednje težine kisikovih atoma, dok se pri mjerenjima sa masenim spektrografom pokazala zgodnom »fizikalna« jedinica atomne težine, koja je 1/16 atomne težine najobičnijega izotopa O16. Kemijska je jedinica dakle nešto veća od fizikalne. Njihov je omjer približno 1,0002. Za samu kemijsku jedinicu nastaje poteškoća otuda, što se pokazalo, da je kisik atmosfere nešto malo teža smjesa izotopa, negoli kisik u vodi. Razlika njihovih srednjih atomnih težina iznosi 0,0001.
Isprva otkrivenim radioaktivnim izotopima i stabilnim izotopima, koji su se našli masenim spektrografom, treba dodati još velik broj izotopa umjetno radioaktivnih dobivenih od 1934 (→ radioaktivnost umjetna). S time je broj poznatih nam atomskih podvrsti premašio pola tisuće. Malone svi cijeli brojevi od 1 do 239 (atomna težina uranova 238,07) zauzeti su izotopima kao njihovi maseni brojevi; mnogi dakako po više puta, te je na pr. 80 maseni broj najobičnijeg izotopa elementa selena, zatim umjetno radioaktivnog broma, najposlije stabilnog izotopa kriptonova. Unatoč praktički jednakim težinama ti se dakle atomi kemijski razlikuju. Oni su izobarni (βάρος težina). Još su zanimljivi izomerni atomi (→ izomerija jezgre), koji su ujedno izotopni i izobarni, t. j. jednakih kemijskih svojstava i jednako teški, a ipak različni po radioaktivnosti. Tako postoje dva atoma bromova Br80, jedan s polovičnim vremenom 18 min, drugi sa 4½ sata.
11. Zgrada atomova; redni broj. Pojavi elektrolize upućuju na to, da je elektricitet u sastavu atoma važan činilac. O tom se sastavu međutim nije moglo ništa potanje reći, dok se nisu upoznale neke krhotine atoma, u prvom redu elektron. Negativna električka čestica elektron otkrivena je najprije kao »slobodna« čestica, i to u katodnim zrakama, te se naskoro zaključilo, da joj je elektricitet onolik, kolike su najmanje množine pozitivnog i negativnog elektriciteta kod elektrolize, naime e=4∙8<znak>10−10 el.-st.cgs-jed. Za masu njegovu izašlo je, da je malena spram mase najlagljega atoma, vodikova, tako da se te mase odnose kao 1 : 1840. Budući da elektroni izlijeću iz katode u Crookesovoj cijevi, ili opet iz vodiča, na koje svjetlost pada, ili spontano — pod imenom betazraka — iz nekih radioaktivnih tvari, zaključujemo, da su oni dijelići atoma. Isto držimo o alfačesticama, što ih emitiraju druge radioaktivne tvari. Za te čestice pokazali su Rutherford i Geiger 1908, da su pozitivno električki atomi plina helija He4 s elektricitetom 2 e. S tim znanjem Rutherford je ispitivao raspršivanje alfačestica na raznim elementima, pa je određujući smjerove, kojima su se alfačestice odbijale, došao do spoznaje, da je atom građen od pozitivno električke »jezgre« i elektrona, koji su oko jezgre (1910). Budući da atom u običnom svom stanju kao cjelina nije električan, negativni elektricitet svih elektrona zajedno, jednak je onda elektricitetu jezgre, tako da je elektricitet jezgre N e, gdje je N cio broj. Kako je masa elektrona malena, sva je masa atoma sadržana u jezgri. Jezgra električnom silom privlači elektrone, jer su protivno električni; u drugu se ruku elektroni međusobno odbijaju; pod igrom tih sila elektroni se razmjeste u prostor, koji je mnogo veći od jezgrina prostora. Odbojne sile elektrona određuju dakle obujam atoma i čine atom neprodirnim za druge atome. Za brze sitnije čestice atom međutim nije neprodiran, već je gotovo »prazan« (Lenard 1903), te na pr. brzi elektroni katodnih i betazraka velikim dijelom kroza nj nesmetano prolaze. Ako alfačestica udari o atom, elektroni je svojom privlačnošću ne će skrenuti s njezine staze, jer imaju premalene mase, ali jezgra, kako ima veliku masu, odbojnom silom promijeni smjer gibanja čestice. Veličina toga skretanja od prvobitne staze stoji do toga, kolika je odbojna sila, dakle između ostaloga do toga, kolik je elektricitet jezgre, kolik je broj N. S pomoću scintilacija cinkova sulfida mogu se staze alfa-čestica ispitivati, a iz skretanja tih staza može se onda odrediti jezgrin elektricitet. Taj prvi način ispitivanja jezgre ne odlikuje se točnošću, te je Rutherford našao na pr. za zlato, da mu jezgra ima elektricitet »od prilike 100 e« (umjesto 79 e).
Van den Broek iznosi misao (1912), da je elektricitet jezgre, t. j. broj N ona tražena veličina, karakteristična za kemijski elemenat i da valjani poređaj elemenata u periodičkom sustavu nije drugo nego li poređaj po brojevima N, poređaj po elektricitetu jezgre. Prvi atomi sustava, vodikov i helijev imaju dakle elektricitet jezgre e dot. 2 e, treći 3e. Za prva dva elementa o toj se tvrdnji jedva moglo sumnjati. Iz pokusa J. J. Thomsona bilo je poznato, da se vodikov atom ne da jače elektrizirati nego li do naboja e; prema Broekovoj hipotezi u tom je slučaju vodikovoj jezgri oduzet njezin jedini elektronski drug, te je jezgra ostala sama. A što se tiče helija, nisu ni tu bili poznati atomi, koji bi imali veći naboj nego li alfačestica, koja dakle nije drugo nego li jezgra atoma helijeva. Teže je bilo odrediti N za druge elemente. Značilo je to nanovo izgraditi periodički sustav. Broek se držao mišljenja, da je N približno jednak polovici (kemijske) atomne težine, pri čemu bi dakako vodik bio očita iznimka. Na tom osnovu pridijelio je najtežemu atomu, uranovu, 118. mjesto u sustavu (umj. 92.!), a to je značilo uvoditi u sustav svu silu novih praznina.
Na drugi je način dokučio »redni broj« elementa Moseley. On je istraživao t. zv. karakteristične rentgenske spektre. Za razliku od svjetlosnih spektara ti su spektri jednostavni i kod raznih elemenata slični. Ako u rentgenskoj cijevi stavimo kao antikatodu jedan za drugim elemente redom, kako dolaze u periodičkom sustavu, karakteristične rentgenske zrake postaju sve prodirnije, što znači, da im frekvencija (t. j. broj titraja u sekundi) postaje sve veća. Ako frekvenciju odabrane spektralne crte na pr. t. zv. Κα-crte označimo sa ν, prema Moseleyu √ν raste od elementa do elementa za jednaki iznos: ta veličina jednako je narasla, kad je Moseley manganovu antikatodu nadomjestio željeznom, kao kad je željeznu zamijenio kobaltovom, kobaltovu nikaljevom i t. d., gdje mangan, željezo, kobalt, nikalj i t. d. redom slijede u periodičkom sustavu. U tom je zakonu Moseley upoznao ono traženo pouzdano sredstvo za ređanje elemenata. Baš primjer kobalta i nikalja, koji čine anomaliju u sustavu Menedelejeva, lijepo je to potvrdio. Prva istraživanja Moseleyjeva (1913) obuhvatila su elemente od kalcija do cinka, što čini samo 10 pomaka u periodičkom sustavu. No već iduće godine saopćio je rezultate o elementima od aluminija do zlata i »uz pretpostavu, da je aluminij 13. elemenat«, nalazi, da je zlato na 79. mjestu. Moseley bijaše uvjeren, da dobiveni cijeli brojevi ne mogu biti drugo nego Broekovi redni brojevi t. j. mjere za elektricitet atomske jezgre. Kad je na to Kossel iste godine u teoretskom razmatranju dokučio mehanizam, kojim pod utjecajem jezgrina elektriciteta nastaju karakteristične zrake, ta se slutnja pokazala potpuno opravdanom. I kad su najposlije Siegbahn i Friman (1915) Moseleyjevom metodom pokazali, da je torij 90., a uran 92. elemenat, nije više bilo sumnje, koliko ima elemenata u periodičkom sustavu od vodika do urana. Pokazalo se onda, da još nisu otkriveni elementi 43., 61., 72., 75., 85. i 87. Od njih su se — baš s pomoću rentgenskih spektara — našli 72., hafnij (1923) i 75., renij (1925).
Da se u atomskom simbolu označi redni broj, stavi se taj broj nisko ispred atomskih slova, na pr. za kisik 8O, klor 17Cl, obični vodik 1H1, teški vodik 1H2. Najlaglja jezgra, t. j. jezgra atoma H1 zove se proton, jezgra atoma H2 zove se deuteron.
Iza novih spoznaja nije se više moglo sumnjati o Rutherfordovu atomu. Pitanje sveze tvari i elektriciteta bilo je s time do nekoga stupnja riješeno. Tvar i nije drugo nego li električnost, jer su eto i jezgra atomska i njezin okoliš električni, te su tvar i elektricitet nerazdruživo povezani. S toga gledišta poznate hipoteze o elektricitetu, što nam ih je namro 18. vijek, izlaze u novom, zanimljivom svjetlu. Električna struja u bakrenoj žici nije drugo nego struja negativnog elektriciteta, naime gibanje elektrona, koji su se od atoma otkinuli. Uostalom razlaganja ovoga i prošloga odsjeka pokazuju, da atom današnje fizike nije isto što i atom starih filozofa: on nije više atomos, t. j. nije nerazdjeljiv.
12. Atomska ljuska. Elektroni oko atomske jezgre čine t. zv. atomsku ljusku, koja je nosilac različitih svojstava. Tu ljusku treba zamišljati građenom od »slojeva«, kojih broj raste, kad u periodičkom sustavu napredujemo k većim rednim brojevima. Pritom se slojevi dodavaju u glavnom izvana (kao godovi drveta!). Zovu se K-sloj, L-sloj i t. d. radi uloge, što je imaju pri stvaraju K-crta, L-crta i t. d. rentgenskih spektara. K-sloj je najbliži jezgri, povrh njega L-sloj i t. d. Kako redni broj raste, unutarnji se slojevi sve više suzuju, jer ih stežu sve veći jezgrini elektriteti. Ako kemijske sile atoma pripišemo poglavito njegovim perifernim elektronima, tumači se periodičnost u sustavu Mendelejeva time, što kemijski slični elementi imadu slično građen izvanji sloj. Tako na pr. u alkalijskim kovinama jedan jedini atom tvori izvanji »sloj«; kod litija — s 3 elektrona — to je L-sloj, kod natrija — s 11 elektrona — taj izvanji sloj jest M-sloj i t. d. Treba dodati, da su takve pomisli u ređanju elektrona u slojeve — baš iz kemijskih razloga — iznesene još i prije Rutherfordove atomske koncepcije. Dok pri stvaranju rentgenskih zraka sudjeluju elektroni, koji su bliži jezgri, svijetlenje se atoma izazivlje elektronima perifernima. Svjetlosni spektri atoma, kojih su zakoni u mnogo slučajeva iz iskustva bili poznati velikom točnošću, omogućili su, da se Rutherfordova nauka dalje izgradi. To je izveo Bohr, koji je u dalekosežnom teoretskom radu objasnio strukturu atomske ljuske u mnogim tančinama.
Bohrova nauka o atomu (1912 i dalje) primjenjuje na osebujan način → Planckov kvant djelovanja »h« i → Einsteinovu korpuskularnu hipotezu o svjetlosti. Kolikogod se oslanjala na klasičnu mehaniku, toliko ipak bijaše izgrađena protiv njezina duha, a nije bila u skladu s elektrodinamikom. Prilagođena svrsi, da protumači tada poznate spektre i da dokuči nove spoznaje, postizava taj cilj s neslućenim uspjehom, no pritom ostaje u svojim osnovima nejasna. Značajno je za Bohrov atom, da se u toj koncepciji zamišljaju elektroni, kao da oko atomske jezgre kruže u manje više zamršenim stazama. Poradi toga imadu te staze, a s njima i atom kao cjelina, »impulz vrtnje«. Kako osim toga elektricitet, koji se giblje, izvodi magnetske sile, stvaraju elektronske staze magnetičnost atoma. Nadopunio se taj nazor, kad su Goudsmit i Uhlenbeck 1925 svakom pojedinom elektronu pridijelili mehanička i magnetska svojstva, kao da se vrti oko svoje osi. Brojevno se to svojstvo izrazuje kao »spin« elektronov, što ima značiti impulz vrtnje elektrona, te se dodaje impulzima staza. (Spin engl. vrtnja, na pr. kod zvrka). Može se dakle atom isporediti sa sunčanim sustavom, jezgra sa suncem, elektroni sa planetima, elektronski spin s impulzom planetove vrtnje. Takvo shvaćanje atoma bilo je od prvoga časa u teoretskoj provedbi puno logičkih teškoća, te se najposlije nadomjestilo atomom kvantne i valne mehanike (v.), matematičkim tvorevinama neznatne ili nikakve zornosti. Odonda traže teoretičari čistunci, da se Bohrov atom sasvim ukloni iz fizike, dok drugi dopuštaju ili preporučuju, da u primjerenim granicama i nadalje služi kao odlična zamjena za teže shvatljive stroge pojmove.
13. Atomska jezgra. Razumljivo je, da »fizika jezgre« nije tako brzo napredovala kao upoznavanje ljuske. Znamenit poticaj u tom smjeru dadoše Rutherfordovi pokusi, u kojima je alfačesticama »razbijao« dušikove atome (1919). Puštajući brze alfazrake kroz dušik mogao je pokazati, da iz dušika izlijeću »pozitivno električki vodikovi atomi«, dakle vodikove jezgre, protoni. Takva protonska zraka nastaje svaki puta, kad alfačestica dobro pogodi jezgru dušikova atoma. Taj je proton bio sastavni dio jezgre, iz koje ga je oslobodio udarac alfačestice. Nova ta spoznaja pobudila je najveću pažnju, jer se evo pokazalo, da uz nestalne, radioaktivne atome, postoje još i tobože stabilni atomi, koji se ipak mogu umjetnim putem razarati. Bio je to prvi korak u nizu otkrića »kemije jezgre« ili »nove alkemije«, kako gdjekada slikovito zovu nauku o umjetnoj pretvorbi atoma. Za sam Rutherfordov primjer kasnije se pokazalo, da dušikova jezgra N uhvati alfačesticu i izbaci proton, tako da se pretvori u jezgru rijetkoga izotopa kisikova O17, prema »nuklearnoj jednadžbi« (nucleus lat. jezgra) 7Nl4+2α4=8O17+1H1, u kojoj donji brojevi pokazuju elektricitet jezgre, gornji maseni broj.
Nove spoznaje upućivahu na mišljenje, da je jezgra građena iz protona i elektrona, najsitnijih čestica poznatih u ono doba. Prema tome bi klorova jezgra 17Cl35 sastojala iz 35 protona i 35—17=18 elektrona. Međutim teoretičari primijetiše, da se takav sastav kosi s novom kvantnom naukom, te već s razočaranjem pomišljahu, da će tu — inače toliko uspješnu nauku — trebati pri istraživanju jezgre nadomjestiti nekom bitno novom mehaničkom koncepcijom. To se nezgodno stanje međutim iz osnova promijenilo, kad je 1932 otkriven neutron, čestica — kako joj ime kaže — bez elektriciteta. Kako je masa te čestice približno jednaka protonovoj masi, odmah se pomišljalo, da se možda jezgra sastoji od protona i neutrona. Takav sastav izlazi i jednostavniji, jer na pr. u jezgri 17Cl35 prema novom tom shvaćanju ima 17 protona i 35—17=18 neutrona svega 35 čestica (kolik je maseni broj), dok bi ih po starijem mišljenju bilo svega 35 + 18=53. Teoretski je branio novo shvaćanje Heisenberg (1932), te je ono opće priznato.
Zadaća je teorije jezgre da objasni radiaktivnost, umjetnu i prirodnu, i premnoge njezine zakonitosti, što ih nađe eksperimentalna fizika. Tu su »spektri« korpuskularnih zraka i gamazraka, koje sve potječu iz jezgre, te ih treba tumačiti strukturom jezgre, slično kako se spektri svjetlosti i rentgenski objašnjavaju strukturom ljuske. A tu je i pitanje polovičnoga vremena: zašto se od jedne vrsti atoma polovica raspadne tekar nakon miljardu godina, od druge već za miljuntinu sekunde? I zašto ima atoma, koji, ako ih ne diramo, kao da živu u vječnost?
Svjetlosni spektar atoma u glavnom je rezultat događaja među elektronima ljuske. Kako se razmještaj tih elektrona ravna prema elektricitetu jezgre, izlazi, da izotopi imadu jednake spektre. To bi međutim točno vrijedilo, kad jezgra ne bi još i neposredno utjecala. Ponajprije bi trebalo za takvo točno poklapanje spektara, da masa ljuske bude beskrajno sitna spram mase jezgrine, a ne samo neznatna. Budući da to nije, to su na pr. crte u spektru atoma teškoga vodika H2 nešto pomaknute spram crta u spektru atoma običnog vodika H1. No osim masenoga broja utječe na atomov spektar još i jezgrin spin s jezgrinim magnetskim momentom, koji stvaraju »hiperfinu« strukturu spektralnih crta, kakva se očituje samo u spektroskopu najjače rastvorne snage. Spektar time postaje sredstvo za nalaženje jezgrina spina i magnetizma, a s time i za istraživanje jezgrina sastava.
Ako se izotopi pregledno svrstaju prema broju jezgrinih protona i neutrona, nalaze se mnoge pravilnosti u tim brojevima. Među njima se nadasve ističe činjenica, da je broj neutrona krupno uzeto jednak broju protona, redovno — kod težih atoma vazda — nešto veći. Koje su sile tome uzrok? I zašto ne poznajemo jezgara s najrazličitijim brojevima sastavnih čestica? Zašto ne poznajemo jezgre s rednim brojem bitno većim od 92 (uran)? Da odgovori na takva pitanja, ispituje kvantna nauka nove sile među protonima i neutronima, protonima i protonima, pa onda neutronima i neutronima, i nalazi, da su to sile, kojima doseg ne premašuje dimenzija jezgrinih, ali u tom najtjesnijem području nadmašuju međusobnu električku odbojnost protona. Te »sile«, »tajinstvene« s gledišta stare mehanike, postulirane su kvantnom mehanikom.
14. Veličina atoma. Nije teško isporediti veličine atoma, ako im znamo kemijske atomne težine i specifične težine elemenata u krutom ili tekućem stanju. Uzme li se od svakog elementa 1 gramatom (§ 6.), na pr. 23 g natrija i 197 g zlata, bit će u tim množinama jednako mnogo atoma. Kako natrij ima specifičnu težinu 097 g/cm3, zlato 19·3 g/cm3, zaprema 1 g natrija 1 : 0∙97 cm3, 1 g zlata 1 : 19·3 cm3, a 1 gramatom natrija 23 : 0·97 = 23·7 cm3, 1 gramatorom zlata 197 : 19·3 = 10·2 cm3. Kako u tim obujmovima ima jednako mnogo atoma, slijedi, da se prostor, što ga treba natrijev atom, odnosi prema prostoru atoma zlata kao 23·7 : 10·2. Ako sada pretpostavimo, da se u krutom tijelu atomi dotiču, može se — doduše sasvim u krupnim crtama — uzeti, da je dobiveni omjer ujedno omjer atomskih obujmova. Obujam je atoma natrija dakle 2·3 puta veći od obujma atoma zlata, premda je potonji 8·6 puta teži.
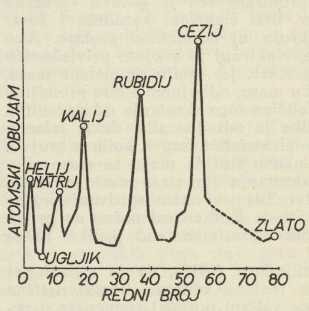
Omjer atomne težine i specifične težine zove se
»atomski obujam«, jer je mjera za manje više određeni pojam pravog atomova obujma. —
L. Meyer je primijetio, da u periodičkom sustavu atomski obujam pada i raste izmjenice, kad raste atomna težina, te je poput kemijskih svojstava periodičko svojstvo elemenata (g. 1870). Slika prikazuje to grafički. U njoj su elementi predočeni točkama, krivulje u pravokutnom koordinatnom sustavu, apscise točaka jesu redni brojevi, ordinate atomski obujmovi. Udara u oči, kako kod alkalnih kovina natrija, kalija, rubidija i cezija atomni obujmovi dosižu maksimum. Bohrova nauka lako to tumači.
Ako znamo broj atoma, može se naći, koliko cm3 zaprema atom. Tako na pr. 1 gramatom zlata t. j. 10·2 cm3 zlata sadržaje 6·03X1023 atoma (→ § 6). Dakle pripada svakom atomu zlata prostor 10·2 : (6·03X1023) = 16·9X1024 cm3. Ako taj prostor shvatimo kao kocku, izlazi brid takve kocke = 3√obujam = 2·6X10-8 cm = 2·6 å. Tolik je dakle — u krupnim crtama uzeto — promjer atoma zlata. Poprijeko se može reći, da atomima pripadaju promjeri nešto veći od 0,000000 01 cm ili kraće 10-8 cm.
Za atomske jezgre odredio je Rutherford, da su im pro mjeri mnogo manji: 10
-13 do 10
-12 cm t. j. ispod bilijuntine cm. Za razliku od periodičnosti obujma cijelog atoma obu jam jezgre raste, kad raste masa atoma, te je s njom približno razmjeran (→
Atomistika, → Elemenat, → Stehimetrija).
15. Atom točka. Po Boškoviću atom nema nikakva obujma; sva je masa njegova u
točki i atomi djeluju jedni na druge silama u daljinu, bez doticaja (→
djelovanje u daljinu). Što je atom današnje fizike složen, ne protuslovi Boškovićevoj nauci, jer bi se moglo uzeti, da su zadnje sastojine naših atoma točke, t. j. atomi u smislu Boškovićevu. Međutim prema učenju kvantne nauke načelno se ne može ništa reći o obliku najsitnijih čestica, te je zamisao atoma točke prema današnjemu shvaćanju iluzorna. — Valjda pod dojmom Boškovićeve nauke uveo je Laplace u dinamiku naziv »tvarna točka« kao zamjenu za »tijelo«, kad ne treba razlikovati dijelove tijela. Ima razmatranja, gdje se atom uzimlje kao tvarna točka u tom smislu. Boškovićev atom bio bi tvarna točka u doslovnom smislu riječi.
LIT.: Bechert u. Gehrtsen, Atomphysik I., 149 str. (Göschen 1009), Berlin, de Gryeter, 1938; Castelfranchi, Fisica moderna, 5. izd., XII+ 740 str., Milano, Hoepli 1938 (jednostavno teoretski); Gregory, A Short History of Atomism, 258 str., London, Black, 1931; Heisenberg, Schrödinger, Dirac, Die moderne Atomtheorie, 45 str., Leipzig, Hirzel, 1934 (Nobel-predavanja); Perrin, Les atomes, rédaction nouvelle, XXIV+319 str. Pariz, Alcan, 1936 (svestrano, vlastiti pokusi); Membres of the Physics Staff of the University of Pittsburgh: An Outline of Atomic Physics, 2. izd., VIII+414, London, Chapman & Hall, 1937; Speakman, Modern Atomic Theory, 208 str., London, Edw. Arnold & Co., 1938 (bez matematike); Thibaud, Vie et transmutations des atomes, 236 str. XXIV table, Pariz, Michel, 1937 (vlastiti pokusi); Wulf, Die Bausteine der Körperwelt, VI + 188 str., Berlin, Springer, 1935 (popularno); Zimmer, Umsturz im Weltbild der Physik, 4. izd., 290 str., München, Knorr & Hirth, 1938 (popularno). St. H.
Atomska rešetka → Kristalizacija minerala.
A. toplina nekoga kemijskog elementa jest umnožak atomske mase, izražene kemijskim jedinicama, i specifične topline. To je dakle toplina, koju valja pri ugrijavanju za 1º C dovesti množinu tvari, u kojoj ima
A atoma
(A, Avogadrov broj — 6∙03 ∙ 10
23, →
atom, 6). Na pr. kod bakra je atomska masa 63∙6, specifična toplina kod obične temperature 0∙101, dakle atomska toplina kod obične temperature 6∙4. →
Dulong-Petitov zakon. St. H.