AFINITET, kemijski, je sila, koja veže atome u molekule i molekule u nove spojeve. Već je Albert Veliki 1193— 1280 nazvao tu silu lat. affinitas t. j. srodnost po braku ili sklonost za spajanjem. T. Bergman (1775) proučavao je kemijski afinitet, pa razlikuje privlačenje između istovrsnih i raznovrsnih čestica, te izbirljivu sklonost (attractio electiva). Berzelius (1810) zamišlja kemijske sile privlačenjem električne prirode i drži, da su tvari izgrađene od elektropozitivnih i elektronegativnih atoma ili atomskih skupina (dualistička teorija). No budući da mnoge spojeve ne možemo rastaviti u pozitivni i negativni dio, razvila se kasnije unitaristička teorija, osobito za organske spojeve. Afinitet je po tome shvaćanju neka posebna sila neelektrične prirode (Kekulé, 1858). Kemijski afinitet ovisi o prirodi tvari. Alkalijske kovine i halogeni elementi imaju međusobno veliku sklonost spajanja, a plemenite kovine spram većine tvari imaju slabi afinitet. Afinitet postoji i među atomima istog elementa, jer se i oni mogu vezati u molekule (H2, O2, N2 i t. d.). Poznato je, da vodik i kisik posjeduju međusobno veliki afinitet, a ipak ti plinovi mogu biti pomiješani, a da ne dođe do vidljivog spajanja tako dugo, dok kroz praskavac ne preskoči iskra ili dok se on ne upali. U tom momentu teče reakcija eksplozivno. Afinitet ne ovisi o brzini, kojom tvari međusobno reagiraju. Utjecaj je topline, svjetlosti, katalizatora i t. d. na afinitet samo prividan, jer mijenja brzinu reakcije, t. j. ubrzava spajanje. Radi toga ne možemo mjeriti kemijski afinitet po brzini neke reakcije.
Veliki broj kemijskih reakcija teče uz razvijanje topline (egzotermijski procesi), zato su J. Thomsen (1852), a osobito M. Berthelot (1867) smatrali, da po množini topline, koja se razvija kod neke kemijske reakcije, možemo mjeriti jakost afiniteta. Berthelotov princip kaže, da od više mogućih reakcija u nekom sistemu teče ona, koja je praćena najvećim razvijanjem topline. Berthelot je određivao afinitet kao veličinu energije i smatrao taj princip temeljnim zakonom termokemije i kemijske mehanike. Mnoga su termokemijska mjerenja potvrdila ispravnost toga principa, no ipak su neki istraživaoci ustvrdili, da taj princip ni s teoretskog ni s eksperimentalnog stajališta nema opće značenje (Horstmann, Rathke, Helmholtz, Boltzmann i dr.). Za kemijske je reakcije važan ne samo afinitet, već i količina tvari, koje sudjeluju u procesu (Guldberg i Waage, → Zakon o djelovanju masa). Promotrimo reakciju, koja ne teče potpuno, već stane prije nego se komponente potpuno pretvore:
A+B ⇄ C+D+q cal
Takove kemijske procese zovemo reverzibilnim ili obrtljivim procesima, jer mogu teći u dva smjera. Proces, koji teče s lijeva na desno, jest egzotermijski, a obratni je proces endotermijski. Prema Berthelotovu principu mogli bi sami od sebe teći samo egzotermijski procesi, a ipak ima veliki broj reakcija, koje teku endotermijski i kod sobne temperature, a pogotovo kod viših temperatura (otapanje, taljenje, isparivanje, redukcija kovina i t. d.). Iz svega toga slijedi, da afinitet ne možemo mjeriti po reakcijskoj toplini. Kemijski procesi kao i ostali prirodni procesi, ako im izvana ne dovodimo energiju, teku samo u onom smjeru, u kojem mogu vršiti radnju. Budući da svaki kemijski proces teče zbog afiniteta, došao je van’t Hoff (1883) do zaključka, da je maksimalna vanjska radnja nekog kemijskog procesa prava mjera afiniteta. Tek one kemijske reakcije mogu vršiti radnju, koje mogu teći same po sebi (princip maksimalne radnje). Predznak se maksimalne radnje mijenja prema smjeru reakcije. Maksimalnu radnju možemo izračunati iz osnovne termodinamičke jednadžbe: A—U = T X dA/dT. U toj je jednadžbi A = maksimalna radnja, U = toplina reakcije, T = apsolutna temperatura.
Član dA/dT je temperaturni koeficijent maksimalne radnje. Iz gornje jednadžbe slijedi, da je A = U, kada je T = 0. Dakle je kod apsolutne ništice maksimalna radnja jednaka toplinskom efektu reakcije, pa tu potpuno vrijedi Berthelotov princip. Zato nam je razumljivo, zašto Berthelotov princip kod niskih temperatura češće vrijedi nego kod visokih i zašto s većom vjerojatnošću očekujemo endotermijske procese, što se više udaljujemo od apsolutne ništice. Kod niskih temperatura redovno teku kemijske reakcije uz razvijanje topline (asocijacije), dok kod visokih temperatura teku češće kemijska rastvaranja (disocijacije). Kemijski afinitet možemo mjeriti poznavajući maksimalnu radnju, koju vrši neki proces. Ima za to više metoda. Jedna se vrsta metoda osniva na mjerenju promjena slobodne energije. Iz jednadžbe izoterme reakcije A = —RT ln K možemo vrlo jednostavno izračunati maksimalnu radnju, ako izaberemo koncentracije = 1. U toj jednadžbi znači K konstantu ravnoteže ili konstantu disocijacije. Treba samo znati, koliko je K, pa ćemo lako izračunati A za stanovitu temperaturu. Druga se metoda osniva na određivanju elektromotorne sile u galvanskim člancima. Ta je metoda vrlo točna i jednostavna. Električnu radnju dobijemo iz kemijskih procesa, koji teku u galvanskim člancima; obrnuto, električnom energijom izazivljemo kemijske promjene u elektrolitičkoj kupci (→ Elektroliza). Kemijski su procesi u galvanskom članku reverzibilni, pa je dobivena električna energija jednaka maksimalnoj radnji. Budući da je radnja (A) jednaka produktu napetosti (E) s množinom elektriciteta (n ∙ F), imamo: A = nF ∙ E. Ako procese u galvanskom članku provodimo izotermički i reverzibilno, dobivena je radnja maksimalna, te je mjerom slobodne energije ili kemijskog afiniteta. Veličinu nF (množina elektriciteta u kulonima) možemo lako odrediti, pa mjerenjem elektromotorne sile (E) nalazimo maksimalnu radnju (A) ili afinitet dotične kemijske reakcije.
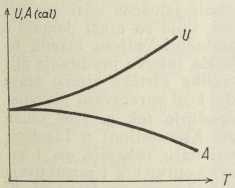
Konačno treba spomenuti, da i čisto termokemijskim načinom možemo odrediti afinitet nekog kemijskog procesa. Po drugom glavnom stavku termodinamike A je funkcija od T. Rečeno je, da je kod apsolutne ništice A=U, no često je i kod običnih temperatura A=U. To je dovelo W. Nernsta (1906) do novog teorema, koji obično nazivamo trećim glavnim stavkom termodinamike. Nernst uzimlje, da krivulja A u blizini apsolutne ništice teče u neposrednoj blizini krivulje U, i da kod T=0 imaju obje krivulje zajedničku tangentu, one se asimptotički dodiruju (slika). Matematički možemo to formulirati ovako: za T=0 je lim dA/dT=lim dU/dT=0. Radnju A možemo izračunati iz termijskih veličina (reakcijske topline i specifičnih toplina). Nernstovim je teoremom protumačena vrijednost Berthelotova principa i zašto on približno točno vrijedi kod niskih temperatura (za termodinamičara je i sobna temperatura niska).
Na temelju novih atomskih teorija pokušala se protumačiti bit onih sila, koje vežu atome u molekule i konačno molekule u još veće komplekse (→ elektroni valencija, polarno i heteropolarno vezivanje, van der Waalsovo vezivanje).
LIT.: M. Berthelot, Essai de mécanique chimique, Pariz 1878; J. H. van ’t Hoff, Vorlesungen über theoretische und physikalische Chemie, 2. izd. Braunschweig, F. Vieweg & Sohn, 1901; W. Nernst, Theoretische Chemie, 11.—15. izd., Stuttgart 1926; Lewis i Randal, Thermodynamics and the free energy of chemical substances, London, New York; J. Eggert, Physikalische Chemie, 4. izd. 1937. M. D-ć.
Afinitet → Tazbina.