EKVIVALENCIJA MASE I ENERGIJE. Einsteinov zakon. Vođen specialnom teorijom relativnosti Einstein je zaključio (1905), da su masa i energija ekvivalentne, te svakoj masi treba pripisati i energiju, svakoj energiji masu. Masa m gram isto je, što i energija E erg, ako je E = c2 m,
gdje je faktor razmjernosti kvadrat brzine svjetlosti u praznom prostoru, c=2∙998X1010 cm/sek. Prema tome utez 1 g sadržava golemu energiju 899 trilijuna erg = 25 milijuna kilovat-sati, a u energiji 1 erg treba gledati i masu 3∙33 X 10-21 g = 670 kemijskih jedinica mase (to je jedinica tablice atomnih težina).
Gornja jednačba uzko je povezana s drugom tvrdnjom teorije relativnosti: da masa m tiela raste, kad mu brzinu v povećavamo, i to prema formuli
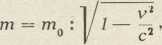
gdje je m0 masa tiela, kad ono miruje. Ako se višak mase u gibanju m nad masom mirovanja m0 izrazi kao energija, t. j. c2m — c2m0, taj je višak — prema nazivu klasične mehanike — energija gibanja ili kinetička energija. Doista, u običnim primjerima, gdje je v maleno prema c, sliedi iz formule za masu algebarskim postupkom cm2 — c2m0= ½ m v2,
poznati izraz za kinetičku energiju u dosadašnjoj mehanici. U takvim primjerima kinetička energija izlazi neznatna, ako se izrazi gramima, te na pr. utez 1 g, koji bi se gibao čak brzinom Zemlje (30 km/sek), imao bi kinetičku energiju-masu samo 0∙000 000 005 g.
Ako tielu dovodimo toplinsku energiju, t. j. ako ga grijemo, po zakonu ekvivalencije raste mu masa. Dovođenjem 1 kilo-kalorije tielo postaje za 46 bilijuntina g teže. Taj sitni porast težine ne bi se dao nikojom vagom pokazati, pa Einsteinov zakon objašnjava, zašto nisu uspjeli dosadašnji pokušaji, da se pokaže pri ugrijavanju tiela porast težine, koji se očekivao na osnovu shvaćanja, da je toplina tvar.
Osnovni zakon kemije, da je kod kemijskih pretvorba zbroj masa svih tvari (misle se mirne mase) na kraju onolik, kolik je bio na početku, s gledišta zakona ekvivalencije samo je približno valjan, budući da se ukupna masa mora onoliko smanjiti, koliko odgovara toplini i radnji, koje su pretvorbom nastale. Ne postoje dva zakona uzdržavanja, zakon uzdržavanja mase i zakon uzdržavanja energije, već jedan, zakon uzdržavanja mase-energije.
Za zakon ekvivalencije dugo nije bilo neposrednog eksperimentalnog dokaza. Danas ih imamo, i to u prvom redu kod pretvorba atomskih jezgara. Kod tih pojava kinetičke energije jezgara poradi njihovih golemih brzina (na tisuće km/sek) nisu tako neznatne, da ne bi primjetljivo utjecale na mase jezgara, te se ovdje promjena mase (mirovanja) može mjeriti, dok bi to kod kemijskih pretvorba bilo nemoguće. Na glasu je primjer elementa litija, na koji puštamo roj veoma ubrzanih protona (to su jezgre običnih vodikovih atoma). Kada proton H1 pogodi jezgru atoma litijeva Li7, obje se jezgre najprije združe, a onda razprsnu u dva jednaka diela, koji polete suprotnim smjerovima: dvie helijeve jezgre He4. Za tu pretvorbu vriedi nuklearna jednačba (→ atom 13)
Li7 + H1 = He4 + He4, gdje brojevi 7, 1 i 4 znače približne mase jezgara (u kemijskim jedinicama). Od mase 7 i 1, t. j. 8, dobivaju se mase 4 i 4, t. j. opet 8. Vrlo točne vriednosti masa poznate su iz mjerenja izvedenih s Astonovim masenim spektrografom. Iz njih izlazi za mase mirovanja, da mase Li7 i H1 zajedno podnipošto nisu točno jednake masi dviju jezgara He4, već da ih nadmašuju za 0∙0185 kem. jed. To smanjenje mase mirovanja razumljivo je: zbroj masa, uzetih u gibanju prema zakonu uzdržavanja, ostaje stalan; zato se zbroj masa mirovanja onoliko smanji, koliko su narasle kinetičke energije. Litijeva je jezgra mirovala, a kinetičke energije protona i helijevih jezgara dale su se odrediti, te se našao porast kinetičkih energija 17∙13 MeV (→ elektronvolt), a taj iznos, preračunan u masu, daje 0∙0184 kcm. jed., dakle u skladu sa smanjenjem mirne mase.
Drugu skupinu potvrda zakona ekvivalencije nalazimo u pretvorbama fotona u elektron i pozitron ili obrnuto (→ elektron).St. H.