AKUMULATORI (električki), naprave na principu elektrolitičke polarizacije (v.), koje izložene nabijanju (punjenju) izvana privedenom električnom strujom »nakrcavaju« energiju te struje (u obliku kemijske energije produkata stvorenih u akumulatoru → elektrolizom); tako postaju posredno (sekundarno) galvanski → elementi, iz kojih je izbijanjem (ispražnjivanjem) moguće nakrcanu energiju dobiti uglavnom natrag u obliku električne struje (na račun kemijskih reakcija protivnoga smisla od onih kod nabijanja).
Ime a. potječe od lat. accumulare (»nakrcavati«). Osobinom, da se slijed procesâ nabijanje-izbijanje može kod a. po volji ponavljati, razlikuju se ovi sekundarni galvanski elementi od primarnih (običnih) galvanskih elemenata, koji sastavljeni mogu odmah davati struju, ali nisu udešeni, da se nakon iscrpljenja regeneriraju strujom izvana.
Zasluga je Gastona Planté-a, da je nakon dugotrajnih pokusa donio (1879) olovne akumulatore, koji se u modificiranim konstrukcijama i danas još najviše upotrebljavaju. Ako se urone u sumpornu kiselinu, razrijeđenu vodom, dvije olovne ploče što veće površine (koje će se same po sebi u kiselini prevući kožicom olovnoga sulfata), stvorit će se na površini tih ploča pod utjecajem elektrolitičkih učinaka struje nabijanja olovni superoksid i čisto olovo, i to (čokoladnosmeđi) superoksid na ploči, na koju struja nabijanja ulazi (anodi), a (sivo) olovo na izlaznoj ploči (katodi). Istodobno će se količina sumporne kiseline nešto povećati, a količina vode u tekućini a. ponešto smanjiti. Nastaje tako galvanski element po shemi: »olovni superoksid PbO2 + smjesa sumporne kiseline H2SO4 i vode H2O + olovo Pb« sa PbO2 kao pozitivnim i Pb kao negativnim polom. Elektromotorna sila toga elementa, nešto iznad 2 volta, kod nabijanja a. suprotstavlja se elektromotornoj sili izvora struje nabijanja (te ova posljednja mora biti veća, da se ona prva može svladati). Naprotiv kod izbijanja a. njegova elektromotorna sila izvodi struju izbijanja kroz strujni krug, sastavljen od a. i priključenoga potrošača; izbijanjem se PbO2 i Pb (na pozitivnom, odn. negativnom polu) pretvaraju oba u PbSO4 i istodobno se polagano troši u tekućini prisutna sumporna kiselina H2SO4, a umjesto nje se stvara voda H2O (jer, kako kod izbijanja struja u tekućini a. teče u smislu obrnutom od onoga kod nabijanja, tako su i elektrolitički procesi protivni). Nakon izbijanja a. se ponovno može nabijati i t. d.
Sumarno uzeto kemijski se procesi kod izbijanja mogu predočiti kemijskom jednadžbom:
PbO2 + 2H2SO4 + Pb = PbSO4 + 2H2O + PbSO4 (I)
Za 1 ampersat (1 Ah) izbijanja a. (dakle za struju 1 amper podržavanu 1 sat ili struju 0,2 ampera podržavanu 5 sati ili sl.) treba teoretski prema jednadžbi (I) 4,46 g (grama) olovnoga superoksida s pozitivne ploče, 3,85 g olova s negativne ploče i 3,66 g sumporne kiseline iz tekućine, da bi se stvorilo ukupno 11,3 g olovnoga sulfata na oba pola i 0,67 g vode u tekućini. Kod nabijanja vrijedi u konačnom rezultatu također jednadžba (I), samo je treba čitati u obrnutom smislu, dakle od desna na lijevo, jer (ukupno uzeto) reakcije kod nabijanja idu u protivnom smislu nego kod izbijanja.
Prema rečenomu će onaj a. moći dati više Ah (ili, kako se još kaže, imat će kapacitet od više ampersati), koji bude imao na pločama više »aktivne mase«, dakle u nabijenomu stanju više PbO2 i Pb prikladnih da se kod izbijanja akumulatora lako pretvore u PbSO4. A stvoreni PbSO4, spužvaste strukture, treba da se kod nabijanja iza toga lako natrag pretvara u PbO2, odn. u Pb. Iskustvo je pokazalo, da se količine aktivne mase, a s njima i kapacitet a. u Ah, dadu povećavati samo postepeno kod akumulatora s masivnim olovnim pločama, kakve je Planté uveo, i to čestim nabijanjima i izbijanjima a., t. zv. formiranjem, koje treba izvesti prije nego se a. dade u upotrebu. Formiranjem se postizava, da kemijski procesi postepeno sve dublje prodiru u ploče a.; samim pretjeranim forsiranjem nabijanja šiljanjem struje punjenja u a., kome se već aktivna masa pretvorila u PbCO2 i Pb, ne postizava se cilj, nego samo to, da se živahno razvijaju na pločama vodik i kisik, što je i kod formiranoga akumulatora znak svršetka nabijanja.
Kod kasnijih usavršenja olovnog akumulatora nastojalo se, da se skupocjeni i neudobni proces formiranja što više skrati, ako ne i potpuno eliminira. S tom svrhom a. se grade mjesto od masivnih olovnih ploča od ploča snabdjevenih mrežom šupljina ili žlijebova ili sličnih prostora, koji se ispune prikladnim pastama s olovnim spojevima.
Olovo se kod ovakovih »ploča s masom« može uzeti više kao nosilac masa, koje kod nabijanja prelaze u PbO2 na pozitivnom polu, a u Pb na negativnom, dok kod izbijanja nastaje spužvasti PbSO4 na oba pola. Već prema fabrikatu detalji konstrukcije ploča s masom dakako variraju, a i pasta je druga za negativne, a druga za pozitivne ploče. Pozitivne se ploče uostalom izvode katkad u obliku »ploča velike površine« s vrlo mnogo naročito gusto nanizanih, dubokih i uskih žlijebova.
Redovito se akumulatori grade s više pozitivnih i negativnih ploča u istoj tekućini (dakle u istom elementu), na pr. s 2 pozitivne i 3 negativne kao u sl. 2. i 3. (odn. uopće tako, da obje vanjske ploče budu negativne). Sve pozitivne ploče priključe se na jednu zajedničku prečku, a sve negativne na drugu prečku. Da bi se postigli s a. viši električki naponi, nego ih daje sam jedan elemenat (sl. 1.), ne treba nego dovoljan broj elemenata spojiti »serijski« u bateriju kao u sl. 2., gdje su 3 elementa, svaki s naponom oko 2 V (volta), spojena u bateriju s ukupno oko 6 V. Naprotiv ako se ne traži više od 2 V napona, ali struja treba da je veća nego je pojedini elemenat po svojoj veličini smije davati, elementi će se spojiti »paralelno« (po shemi kao u sl. 3., gdje su tri elementa spojena paralelno u bateriju, iz koje se smije crpsti triput toliko ampera kao iz pojedinoga elementa. Ispravan razmak između ploča pojedinoga elementa postizava se bilo pomoću rebrastih izbočina na stijenkama (staklene, ebonitne ili slične) posude elementa ili pomoću posebnih separatora od stakla, drveta, ebonita i t. d. Kiselina a. mora biti kemijski vanredno čista, jer i neznatne primjese mnogih soli kvare a.; slično i voda, koja se od vremena do vremena nadolijeva u a. (da se nadoknadi ishlapljena voda i potrošena kod razvijanja vodika i kisika pri koncu nabijanja), treba da je destilirana. Uopće olovni a., da bi dugo trajali i dobro radili, traže pažljivo postupanje (po uputama tvornice): ne smiju na pr. biti izbijani, ni nabijani prejakim strujama, ne smiju nipošto stajati dulje vremena izbijeni i t. d.
 Sl. 1
Sl. 1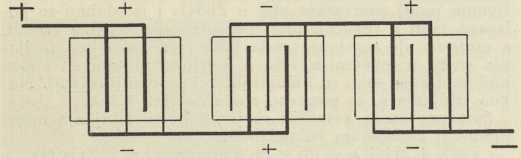 Sl. 2
Sl. 2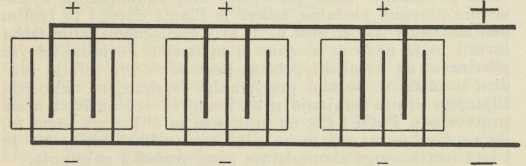 Sl. 3
Sl. 3Od elektromotorne sile
E a. samo se mali dio potroši kod izbijanja za svladavanje unutarnjega otpora a., jer je taj redovito neznatan (maleni dio oma po elementu); tako najveći dio od
E (po elementu skoro 2 V) ostaje raspoloživ za stvaranje struje u priključenom potrošaču. Taj
raspoloživi napon E
k može se mjeriti voltmetrom priključenim između stezaljka
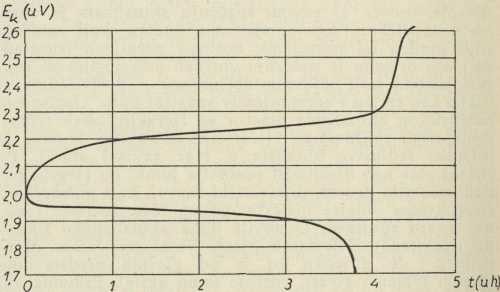
opterećenoga a., pa se i zove »napon stezaljka« kod izbijanja. Tokom izbijanja E
k samo polagano opada, a kad počne naglije padati, to se ima smatrati znakom, da se izbijanje ima prekinuti (na pr. kod 1,8 V; v sl. 4.), gdje
donja krivulja prikazuje, kako napon stezaljka E
k u voltima (V) varira s vremenom izbijanja t u satima (h) u jednom konkretnom slučaju; kod postignutog E
k = 1,8 V nakon 3,75 h izbijanje bi se prekinulo). Kod nabijanja napon stezaljka E
k je znatno veći, jer sada se elektromotornoj sili a. (koja je kod nabijanja ponešto povećana, a treba je cijelu svladati) pribraja potrošak napona zbog svladavanja unutarnjeg otpora nabijanoga a. Zato krivulja napona nabijanoga a. (v.
gornju krivulju u sl. 4) ima
 Sl. 4
Sl. 4
vrijednosti E
k iznad onih kod izbijanja (obično u najvećem dijelu nabijanja oko 2,25 V, ali čak do 2,6 V pri kraju nabijanja). Prema tomu, iako je »omjer vrsnoće« a. (broj kod izbijanja od a. danih Ah prema broju kod nabijanja primljenih Ah) obično vrlo povoljan,
energetički »stepen djelovanja« a. zbog razlike napona stezaljki kod izbijanja i nabijanja je osjetljivo lošiji, jer po samom značenju pojma »stepena djelovanja«pod tim treba razumijevati omjer od a. kod izbijanja danih i kod nabijanja primljenih
vat-sati (Wh). Ako se na pr. a. izbija 4,5 h sa 10 A uz prosječno 1,95 V napona stezaljka, a kod nabijanja je trebalo kroz 10 h slati u njega struju kod napona stezaljka od prosječno 2,25 V, njegov omjer vrsnoće je (10 X 4,5)/(10 X 5)=0,90, a stepen djelovanja bi mu bio: (1,95 X 10 X 4,5)/(2,25 X 10 X 5)=0,78. Ili u postocima: prvi bi iznosio 90%, a drugi 78%.
Osim opisanih a. s olovom i kiselinom ima i drugih vrsta, od kojih su najveću raširenost postigli
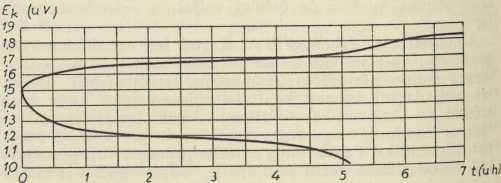
željezno-nikaljni alkalijski a. s lužnatom tekućinom (uglavnom otopinom kalijske lužine KOH). Oni
 Sl. 5
Sl. 5
su manje osjetljivi prema gruboj upotrebi, mogu se izvesti s malo težine, mogu stajati nenabijeni i t. d., no napon stezaljki im je manji i nije tako stalan kod izbijanja, a i stepen djelovanja im je jedva oko 50%. Krivulje izbijanja i nabijanja kod njih teku po prilici kao u sl. 5. Kemijske reakcije sumarno uzeto teku po shemi:
Akumulatori se mnogo upotrebljavaju kao izvori struje, na pr. u automobilizmu, uz prijemne radio-aparate, za uređaje rezervne rasvjete, za tjeranje električkih prevozila i t. d., a u velikim »stacionarnim« baterijama služe kao rezervni izvor struje i za izjednačenje opterećenja dinamo-strojeva kod vrlo promjenljivih pogona.