ALUMINIJ (Aluminium), simbol Al, atomna težina 26,97. Aluminij dolazi u prirodi u raznim spojevima: korundu, kaolinu, ilovači, glini, boksitu i t. d. Iza kisika i silicija aluminij je najrašireniji elemenat na zemlji. U vanjskoj kori Zemlje (16 km) ima oko 8% aluminija u obliku spojeva. Zovu ga kovinom budućnosti. Ime je dobio od lat. riječi alumen = alaun (stipsa), jer u tome spoju dolazi al. uz kalij vezan na sumpornu kiselinu, kako je to našao već A. S. Marggraf (1754). Elementarni aluminij dobio je prvi H. C. Oersted (1825), zatim F. Wöhler (1827) djelovanjem kovine kalija na AlC3. Kasnije je R. Bunsen (1854) dobio al. elektrolizom iz AlCl3 ∙ NaCl, a H. Rose (1855) elektrolizom kriolita Na3AlF6. U većim količinama počeo ga je proizvoditi St. Claire Deville iz boksita, koji se nalazio kod mjesta Baux u južnoj Francuskoj. Cijena je aluminija bila u početku vrlo visoka (srebro iz gline). Danas je aluminij jedna od najvažnijih tehničkih kovina, a cijene su mu mnogo niže.
Fizikalna svojstva al. zavise u velikoj mjeri od čistoće i načina mehaničke i termijske obradbe. Najčistiji al. je bijel poput srebra, manje čist (tehnički al.) je nešto modrikast; 99,6%-tni al. je tvrđi od cinka i kositra, a mekši od bakra. Tali se kod 658°, a već ispod tališta postaje mekan; vri kod 1800°. Spec. tež. lijevanog al. je 2,64, valjanog 2,68, vučenog 2.70. Što je al. čistiji, to je žilaviji, ali manje čvrst. Vodi toplinu dvaput bolje od mekog čelika, no za polovicu gore nego bakar. Spec. toplina al. je 0,22—0,28 (između 50° i 650°), dakle vrlo visoka u poređenju s bakrom i cinkom (0,094), te željezom (0,114), t. j. predmetima iz aluminija treba više topline da se zagriju, no teže se ohlade.
Aluminij je dobar vodič elektricitete, četiri puta bolji od željeza, a oko 60% slabiji od bakra. Dade se valjati u tanke listiće (folije) i razvući u tanke žice.
Kemijska svojstva al. zavise također od njegove čistoće: što je čistiji to je otporniji. Na zraku gubi sjaj, jer se pokriva tankim slojem oksida, koji ga štiti od daljeg djelovanja atmosfere. Destilirana voda i kišnica ne djeluju na aluminij, tvrda voda stvara na njemu sloj, koji ga štiti. Ima vodâ, koje al. osjetljivo nagrizaju. Jake ga lužine (alkalije) otapaju. Amonijak djeluje na nj samo u nazočnosti drugih alkalija i klorida. Mineralne kiseline (osim dušične) otapaju ga. Srednje ga koncentrirana dušična kiselina (20–40%-tna) otapa, dok jakoj i razrijeđenoj odolijeva. Jednako se vlada i prema octenoj kiselini. Od neutralnih otopina jako nagrizaju aluminij otopine halogenida, a napose su opasne za al. živa i živine soli, jer daju s njim amalgam, koji nije otporan niti prema čistoj vodi. Mlijeko, voćni sokovi, pivo, vinska kiselina i t. d. ne djeluju na al. Kako su soli al. bezbojne i neotrovne, eventualna slaba korozija nema utjecaja na izgled, a ne škodi ni hrani priređenoj u aluminijskom posuđu.
Dobivanje aluminija u tehnici. Zasada još ne postoji racionalni postupak dobivanja aluminija iz ilovače ili gline, već samo iz boksita. U banovini Hrvatskoj ima golema količina boksita dobre kakvoće u krajevima našega krša u Lici, Dalmaciji i Hercegovini. Upravo u najsiromašnijim našim krajevima postoje svi preduvjeti za razvitak aluminijske industrije: bogata nalazišta boksita i velike vodene snage. Iz boksita treba najprije dobiti čisti aluminijev oksid Al2O3 (glinicu). U jedinoj našoj tvornici aluminija u Lozovcu kraj Šibenika dobivaju glinicu po Bayerovu postupku. Boksit, koji dolazi iz rudnika (jama), najprije se drobi, suši i oslobađa organskih primjesa. Nakon sušenja samelje se u prah u bubnjevima, koji rotiraju i u kojima se nalaze čelične kugle. Fini prah miješa se u autoklavima pod pritiskom od 7 atmosfera s gustom natrijevom lužinom i grije nekoliko sati (sl. 1). Aluminijev oksid se pritom otapa i prelazi u natrijev aluminat, a neotopljeni ostaju oksidi željeza, titana i silicija (Fe2O3, TiO2 i SiO2), koji u boksitu dolaze u većim ili manjim količinama. Lužina se nakon toga razrijedi vodom, a primjese se istalože u dekanterima kao crveni mulj. Čista se tekućina, zvana aluminatna lužina, siše u velike sudove s mješalicama, pa se iz nje posebnim postupkom (uvođenjem CO2 ili cijepljenjem sa Al(OH)3 i miješanjem) izlučuje aluminijev hidroksid (»hidrat«). Aluminijev se hidroksid odvoji od matične lužine na filterima koji rotiraju, pa se nakon toga žari u kalcinatorima (35 m dugačkim bubnjevima, koji se okreću i griju iznutra generatorskim plinom do 1300°) i prelazi u oksid. Tako dobiveni čisti aluminijev oksid dolazi u električne peći. Te su peći u nizu godina usavršavane (sl. 2). Prve su metode za dobivanje aluminija elektrolizom u električnim pećima izradili P. L. T. Heroult i Ch. M. Hall (1887). U lozovačkoj tvornici upotrebljavaju se nove peći s kontinuiranim elektrodama po Söderbergu.
 Sl. 1. Autoklavi u kojima se samljeveni i sušeni boksit miješa s natrijevom lužinom Tvornica u Lozovcu
Sl. 1. Autoklavi u kojima se samljeveni i sušeni boksit miješa s natrijevom lužinom Tvornica u Lozovcu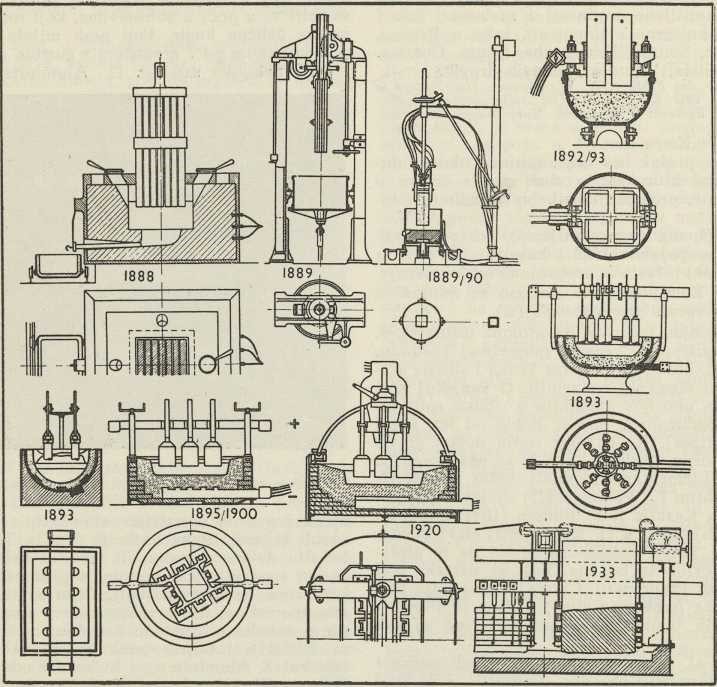 Sl. 2. Razvitak električne peći za dobivanje aluminija
Sl. 2. Razvitak električne peći za dobivanje aluminijaAluminijev oksid dolazi u peći u rastaljeni kriolit (AlF3. 3NaF), koji služi za sniženje tališta kupke (aluminijev oksid tali se kod 2000°, a kriolit kod neko 900°). Al2O3 se elektrolizom rastvara na Al i kisik, dok kriolit teoretski ostaje nepromijenjen. Kao posuda za elektrolizu (»peć«) služi četverouglasti željezni sanduk, podstavljen pečenom smjesom koksa i katrana. To je ujedno katoda, dok je anoda načinjena od vrlo čistog koksa, prešanog u obliku bloka uz dodatak katrana i pakline, pa pečenog kod visoke temperature. Anoda je odozgo uronjena u kupku, koja je od električne struje u rastaljenom stanju (potrebna je istosmjerna struja od 5,5 V i oko 23.000 A). Tekući aluminij, koji je nastao elektrolitskim raspadom aluminijeva oksida, skuplja se na dnu peći, pa se ispušta svakih 48 sati iz peći i lijeva u željezne kokile (kalupe), u kojima se skrutne u trupce i tako dolazi u promet. Takove peći rade kontinuirano. Kisik, koji se izlučuje na anodi, troši ugljen (stvaraju se plinovi CO i CO2, koji se odvode), zato se anoda mora postepeno spuštati u peć i nadoknađivati (sl. 3).
Sirovi aluminij redovno se još jedamput pretali, da se oslobodi mehaničkih nečistoća i da mu se izjednači sastav. Tako dobiveni aluminij može se za osobite svrhe dalje rafinirati do čistoće 99,995% Al i više, ponovnim elektrolitskim postupkom. Rastaljena legura aluminija s bakrom služi kao anoda (A) u kupelji, u kojoj je pokrivena rastaljenim fluoridima, dok rastaljeni čisti Al, kao specifički najlakši sloj, pliva na površini kupke (katoda, K) i odande se skida (sl. 4).
 Sl. 3. Električne peći po Söderbergu za dobivanje aluminija
Sl. 3. Električne peći po Söderbergu za dobivanje aluminija
Tvornica u Lozovcu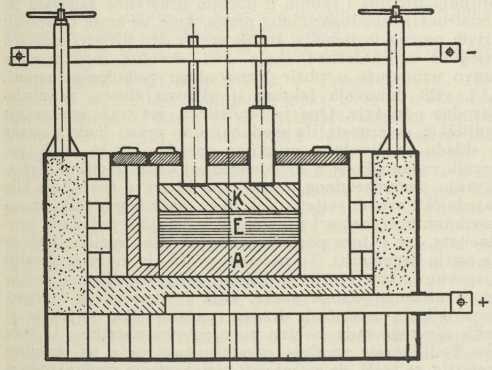 Sl. 4. Rafinacija aluminija (shematski)
Sl. 4. Rafinacija aluminija (shematski)Godišnja svjetska proizvodnja aluminija svake je godine sve veća, pa danas dosiže 800.000—1,000.000 tona. Kod nas je započela proizvodnja aluminija u Lozovcu 1936. Do 1940 instalirane su 54 električne peći, koje mogu proizvesti godišnje 2.400 tona čistog aluminija. Najveći dio struje dobiva tvornica aluminija od hidroelektrične centrale, koja iskorišćuje slapove Krke kod Skradina. Osim čistog aluminija sa preko 99,8% Al proizvodi tvornica u Lozovcu i aluminijske legure sa silicijem, bakrom, manganom i t. d.
Legure aluminija. Dodatkom malih količina drugih kovina, napose bakra, magnezija, niklja, silicija, cinka ili mangana, mogu se mehanička svojstva aluminija znatno poboljšati. Mnoge od tih legura imaju (poput čelika) svojstvo, da im se čvrstoća može osobitim toplinskim obrađivanjem naknadno povisiti. U pogledu otpornosti protiv nagrizanja aluminijeve legure općenito zaostaju za čistom kovinom, ali kod nekih od njih postignuta je osobitim dodacima zamjerna kemijska otpornost uz dobra mehanička svojstva. Od velikog broja legura, koje dolaze na tržište, neka budu ovdje spomenuti: duralumin (Al-Cu-Mg), lautal (Al-Cu), anticorodal (Al-Mg-Si), magnalij (Al-Mg), silumin (Al-Si), scleron (Al-Zn-Cu-Mn-Fe-Si-Li), američka legura za lijevanje (Al-Cu), njemačka legura za lijevanje (Al-Zn-Cu), legura za zvona (Al-Ni).
Aluminij i njegove legure daju se (kao željezo) na sve načine oblikovati i obrađivati, a isto tako i spajati vijcima, zakovicama, lemljenjem i zavarivanjem. Čisti al. može se izvaljati u folije, kojima je debljina tek malo veća od debljine najtanjih zlatnih folija.
Upotreba je al. i njegovih legura mnogostruka i stalno se širi u nova područja, gdje je potrebna kovina malene težine, dobrih mehaničkih, kemijskih i električnih svojstava, te lijepa izgleda. Upotrebljava se za gradnju aeroplana, njihovih armatura i motora; za gradnju željezničkih vagona, automobila i drugih vozila; u elektrotehnici za vodove (mjesto bakra), za dijelove motora i aparata; u kemijskoj industriji za gradnju sprava, posuda, spremišta i dr. Tanke folije aluminija služe za zamatanje živežnih namirnica: sira, čokolade i t. d. (mjesto staniola); u građevinarstvu i arhitekturi za okvire prozora, vrata i sl., te u dekorativne svrhe; u kućanstvu za različito posuđe; u obliku praška kao boja za ličenje (t. zv. aluminijska bronca); za aluminotermiju i t. d.
Aluminotermija je postupak, koji iskorišćava veliki afinitet aluminija prema kisiku za oslobađanje nekih kovina iz njihovih oksida, ili za postignuće visoke temperature. Uvjet je za to, da onaj oksid s aluminijem dovoljno brzo reagira, tako da njihova smjesa (u praškastom stanju, t. zv »termit«) »gori« sama dalje, kad se na jednom mjestu zapali; nadalje mora postala zgura (troska) biti taljiva kod dovoljno niske temperature, tako da se izlučena kovina može ispod nje nakupljati u obliku homogenog regulusa. Aluminotermija upotrebljava se za dobivanje nekih kovina (kroma, mangana, niklja, kobalta, nioba, tantala, ferotitana, molibdena i dr.); nadalje za zavarivanje, napose tramvajskih i željezničkih tračnica. Aluminijev oksid, koji kod aluminotermije otpada (napose onaj od fabrikacije kroma), upotrebljava se pod imenom »korubin« kao umjetni korund za pravljenje brusova.
Aluminijevi spojevi. Aluminij je u svojim spojevima uvijek trovaljan. Njegov je hidroksid »amfoteran«, t. j. daje s kiselinama aluminijeve soli, a s bazama aluminate. Aluminijeve su soli bezbojne; dobivaju se otapanjem Al ili njegova hidroksida u kiselinama, ili dvostrukom izmjenom. Kao soli slabe baze lako u vodi hidroliziraju, pa se na tome osniva upotreba mnogih Al-soli (sulfata, acetata, klorida, oksalata, rodanida, formiata, alauna i dr.) u bojadisarstvu (aluminijska močila). Već prostim parenjem izlučuju Al(OH)3, koji zaostaje na vlaknu i daje s nekim bojama netopive spojeve, t. zv. lakove. Na hidrolitskom izlučivanju Al-hidroksida osniva se i upotreba Al-soli (napose Al-sapuna) za impregniranje tkanina, da postanu nepropusne za vodu. U iste svrhe upotrebljavaju se i topivi aluminati. Najpoznatiji i najvažniji su ovi spojevi aluminija:
Aluminijev oksid, Al2O3, i hidroksid, Al(OH)3, koji služe kao osnova za proizvodnju samog aluminija i njegovih spojeva. U prirodi dolazi Al2O3 kao korund (bezbojni ili žuti leci), rubin (crven od primjesa kroma), safir (modar od titana). Aluminijev oksid, dobiven sagorijevanjem aluminija, bijeli je prašak. Ako ga rastalimo kod 2000° i polako ohladimo, ostaje kristalno proziran. Tako se dobivaju umjetni dragulji. Nečiste vrste korunda služe zbog njegove tvrdoće kao šmirak za poliranje i brušenje. U tehnici služi kao sirovina za dobivanje Al2O3 i Al(OH)3 gotovo isključivo ruda boksit. Dobiva se po mokrom postupku K. J. Bayera (v. naprijed kod dobivanja aluminija). Kod suhog postupka po Le Chatelieru žareni se boksit pomiješa s bezvodnom sodom i u 60 m dugoj peći, koja se okreće, žari, dok se speče; dobivena se masa brzo izluži vodom i iz nje istaloži hidroksid na isti način kao po Bayeru ili uvođenjem ugljičnog dioksida. Iz ocjedine se regenerira soda.
U novije se doba dobiva Al2O3 i Al(OH)3 također elektrotermičkim putem po Haglundu. Boksit se u električnoj peći tali s ugljenom i piritom (FeS2); time se dobiva s jedne strane legura željeza, silicija i titana, a s druge strane troska (zgura), koja sadržava aluminijev oksid uz aluminijev sulfid. Troska se rastvara vodom, time se iz nje istjera sumporovodik (koji se prerađuje na sumporni cvijet ili se uvodi u peći, gdje se žari boksit, tako da mu kasnije treba dodavati manje pirita), a zaostaje smjesa oksida i hidroksida. Oksid služi za fabrikaciju aluminija, a hidroksid (koji je manje čist) vraćaju u proces ili upotrebljavaju za fabrikaciju Al-soli, aluminatnih cementa i dr.
Alauni su dvosoli aluminijeva sulfata s alkalijskim sulfatom, općenite formule MIAl (SO4)2 ∙ 12H2O (gdje je MI alkalijska kovina ili amonij); u širem smislu nazivaju se alaunima i analogni dvostruki sulfati, u kojima je Al zamijenjen drugom trovaljanom kovinom, na pr. željezom (željezni alaun), kromom (krom-alaun). Obični alaun ili kalijev alaun, alumen, stipsa, kocelj, kalijev aluminijev sulfat KAl(SO4)2 ∙ 12H2O dobivao se ranije poglavito iz prirodnog minerala alunita, K(AlO)2 ∙ (SO4)2 ∙ 3H2O (bazički kalijev aluminijev sulfat) žarenjem, mljevenjem sa sumpornom kiselinom, izlučivanjem i kristalizacijom; danas se dobiva iz gline ili kaolina rastvaranjem sa sumpornom kiselinom i kristalizacijom uz dodatak kalijeva sulfata. Upotrebljava se u bojadisarstvu, za strojenje glacé-kože, za lijepljenje papira i kao kamen za brijanje. U kemijskoj tehnici danas se alaun zamjenjuje jeftinijim Al-sulfatom, Al2(SO4)3 ∙ 18H2O, koji se dobiva otapanjem Al-hidroksida u sumpornoj kiselini ili rastvaranjem gline odn. boksita sumpornom kiselinom. Služi i za čišćenje vode, jer hidrolizom nastali talog Al(OH)3 kod taloženja na dno uzima sobom i nečistoće.
Aluminijev klorid. Kristalizirani AlCl3 ∙ 6H2O dobiva se rastvaranjem gline sa solnom kiselinom ili otapanjem Al-hidroksida u solnoj kiselini, isparivanjem i kristalizacijom. Služi za karbonizaciju vune i za čišćenje vode mjesto sulfata. Bezvodni AlCl3 dobiva se sagorijevanjem Al-strugotina u struji plinovitog klora, pri čemu klorid ishlapi i kondenzira se u predloškama. U novije se vrijeme dobiva i grijanjem boksita i ugljena u struji klora. Bezvodni AlCl3 služi mnogo kao katalizator u organskoj kemiji i kemijskoj industriji za provođenje raznih reakcija, isto tako u industriji petroleja za cijepanje ugljikovodika i dobivanje benzina iz težih frakcija petroleja.
Kriolit, AlF3 ∙ 3NaF, nalazi se na Grönlandu kao mineral i odatle se do nedavna isključivo dobivao. Danas se pravi umjetni kriolit dvostrukom izmjenom natrijeva fluorida s aluminijevim sulfatom ili natrijeva aluminata s fluorovodičnom kiselinom. Služi kod dobivanja aluminija, zatim za proizvodnju bijelih emalja, te opalnih i mliječnih stakala. Za bijele emalje služi i umjetni hiolit, 3AlF3 ∙ 5NaF, koji ima veću moć pokrivanja.
Aluminijevi silikati (Alumosilikati) u prirodi su vrlo rašireni i stvaraju glavni dio zemaljske kore. Njihov je sastav često zamršen. Jednostavnijega su sastava andaluzit Al(AlO)SiO4 i disten (AlO)2SiO3, zatim kalijev glinenac KAlSi3O8. Iz glinenca nastaje trošenjem glina, koja je onečišćena željeznim oksidom. Čista glina zove se → kaolin, ima sastav Al2Si2O7 ∙ 2H2O. Glina i kaolin važne su tvari za keramičku industriju. Među aluminijeve silikate ubrajamo lazurit (lapis lazuli), natrijev aluminijev silikat, koji sadrži i sumpora. Slična je sastava umjetno načinjeni ultramarin (v.).
Aluminijev acetat, Al(CH3COO)3, nalazi se samo u svježim otopinama. Dobiva se otapanjem Al-hidroksida u octenoj kiselini, ili dvostrukom izmjenom Al-sulfata s olovnim acetatom. Već kod obične temperature, brže kuhanjem, prelazi u bazične acetate (topive i netopive u vodi). Služi u bojadisarstvu kao močilo za impregniranje tkanina i u medicini za obloge (Aluminium aceticum basicum solutum ili Liquor Burowi). R. P.